Восстановление нитробензола железом в присутствии электролитов
В 1854 г. французским химиком Антуаном Бешаном была открыта реакция восстановления нитробензола железом в слабокислой среде. Этот метод получения анилина, известный как метод Бешана, оказался простым и доступным. Как промышленный метод получения анилина он существует с 1856 г. Достоинствами этого метода являются высокий выход анилина, отсутствие побочных продуктов, дешевизна восстанавливающего агента и простота технологического оформления процесса. Механизм восстановления нитросоединений железом, в частности чугунными стружками, был обстоятельно изучен В.О. Лукашевичем, который показал, что реакция протекает в две стадии. На первой стадии происходит восстановление нитросоединения железом, при этом железо окисляется и образуется гидроксид железа(II) (уравнение (4.2.3)). Гидроксид железа(II) также способен восстанавливать нитросоеди¬нение до амина, превращаясь при этом в гидроксид железа(III) (уравнение (4.2.4)). Реакция идет с большой скоростью. Соотношение скоростей первой и второй стадий определяет соотношение в реакционном шламе оксидов железа, образующихся из гидроксидов путем дегидратации. На соотношение образующихся оксидов железа влияет также наличие избытка чугунной стружки (уравнение (4.2.5)), степень ее измельчения и природа применяемого электролита. При восстановлении в присутствии хлорида аммония, например, в шламе содержится 49,7 % оксида железа (III), а в присутствии хлорида железа (III) содержание оксида железа (III) составляет 74,7 %. С6Н5NO2 + 3Fe + 4H2O → С6Н5NH2 + 3Fe(OH)2 | (4.2.3) | | С6Н5NO2 + 6Fe(OH)2 + 4H2O → С6Н5NH2 + 6Fe(OH)3 | (4.2.4) | | Fe + 8Fe(OH)3 → 3Fe3O4 + 12H2O | (4.2.5) |
Суммарном уравнением реакции восстановления ароматических нитросоединений железом в присутствии электролитов является уравнение (4.2.6). 4С6Н5NO2 + 9Fe + 4H2O → 4С6Н5NH2 + 3Fe3O4 | (4.2.6) |
Как видно из приведенных уравнений, восстановление протекает только за счет железа и воды. Однако чтобы реакция шла успешно, необходимо обеспечить условия влажной коррозии железа. Такие условия создаются при наличии в реакционной массе электролитов. В качестве электролитов применяют растворимые соли железа (хлорид, ацетат, формиат), соли аммония (сульфат, хлорид), реже хлорид натрия и сульфат железа (II). Было показано, что скорость коррозии железа, которая в растворах солей в несколько раз (до 10) больше, чем в воде, зависит от природы и концентрации электролита. Наивысшая скорость процесса наблюдается при использовании хлоридов аммония и железа(II), несколько меньшая — при использовании сульфата аммония. Количество применяемого электролита обычно составляет 0,1–0,2 моль / 1 моль нитробензола. Электролиты вводят в реакционную массу готовыми или (чаще) получают в самом аппарате взаимодействием чугунных стружек с разбавленными кислотами: соляной, серной, уксусной, муравьиной. Этот процесс носит название протравливания чугуна (железа) и производится обычно до добавления нитросоединения. Для восстановления лучше всего использовать стружку серого чугуна — отход металлообрабатывающих заводов. Серый чугун по химической природе представляет собой железо, в котором растворен углерод, образующий обнаруживаемые в микроструктуре чугуна углеродсодержащие компоненты: феррит и перлит, а также графит. Кроме того, в чугуне в небольших количествах содержатся соединения других элементов: Mn, P, Si, S. Химическая неоднородность чугуна является причиной его активности в отношении окисления во влажной среде (влажная коррозия), т. к. обусловливает возможность возникновения элементарных гальванических пар, например, феррит—графит. Выделяющийся при этом на аноде кислород способствует окислению железа. Вследствие зернистого строения серого чугуна его стружка очень хрупка и легко ломается, поэтому при размешивании в процессе восстановления она распадается на мелкие частицы. При этом значительно увеличивается ее поверхность соприкосновения с жидкостью, что ведет к ускорению восстановления. Часто перед употреблением стружку специально измельчают и просеивают. Для восстановления нитробензола в анилин в промышленных масштабах были разработаны два способа: периодический и непрерывный. Периодический способ. Восстановление нитробензола в анилин в аппаратах периодического действия осуществляется в промышленном масштабе более 100 лет без существенных усовершенствований (рис. 4.2.1). Для восстановления нитробензола применяют цилиндрические реакционные аппараты (редукторы), стальные или чугунные, емкостью 10–20 м3, защищенные изнутри от коррозии и истирания кислотоупорной плиткой. Аппараты снабжены мощными тихоходными мешалками, необходимыми для размешивания тяжелого осадка, состоящего из чугунных стружек и оксидов железа. Через полый вал мешалки в аппарат подают острый пар для нагрева массы в начальный период восстановления. Редукторы некоторых конструкций имеют паровую рубашку для обогрева.
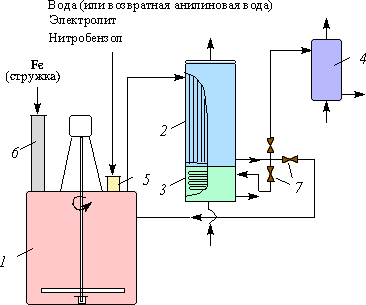 Рис. 4.2.1. Схема установки для получения анилина восстановлением нитробензола:
1 — редуктор; 2 — трубчатый холодильник; 3 — змеевиковый холодильник; 4 — холодильник для легких углеводородов;
5 — штуцер для загрузки реагентов; 6 — труба для загрузки чугунных стружек; 7 — краны
| 