| Рассмотрим процесс получения серной кислоты контактным методом из двух видов сырья: серного (железного) колчедана и серы. 1) Химическая схема получения серной кислоты из колчедана включает три последовательные стадии: - окисление дисульфида железа пиритного концентрата кислородом воздуха: 4FеS2 + 11О2 = 2Fе2S3 + 8SО2, - каталитическое окисление оксида серы (IV) избытком кислорода печного газа: 2SО2 + О2 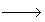 2SО3 2SО3 - абсорбция оксида серы (VI) с образованием серной кислоты: SО3 + Н2О 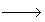 Н2SО4 Н2SО4 По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным и состоит из нескольких последовательно проводимых стадий. Обжиг колчедана в токе воздуха представляет собой необратимый некаталитический гетерогенный процесс, протекающий с выделением тепла через стадии термической диссоциации дисульфида железа: 2FеS2 = 2FеS + S2 и окисления продуктов диссоциации: S2 + 2О2 = 2SО2 4FеS + 7О2 = 2Fе2S3 + 4SО2 что описывается общим уравнением 4FеS2 + 11О2 = 2Fе2S3 + 8SО2, где ΔН = 3400 кДж. Увеличение движущей силы процесса обжига достигается флотацией колчедана, повышающей содержание дисульфида железа в сырье, обогащением воздуха кислородом и применением избытка воздуха при обжиге до 30 % сверх стехиометрического количества. На практике обжиг ведут при температуре не выше 1000оС, так как за этим пределом начинается спекание частиц обжигаемого сырья, что приводит к уменьшению поверхности их и затрудняет омывание частиц потоком воздуха. В качестве реакторов для обжига колчедана могут применяться печи различной конструкции: механические, пылевидного обжига, кипящего слоя (КС). Печи кипящего слоя отличаются высокой интенсивностью (до 10 000 кг/м2·сут), обеспечивают более полное выгорание дисульфида железа (содержание серы в огарке не превышает 0,005 мас. долей) и контроль температуры, облегчают процесс утилизации теплоты реакции обжига. К недостаткам печей КС следует отнести повышенное содержание пыли в газе обжига, что затрудняет его очистку. В настоящее время печи КС полностью вытеснили печи в других типов в производстве серной кислоты из колчедана. 2) Технологический процесс производства серной кислоты из элементарной серы контактным способом отличается от процесса производства из колчедана рядом особенностей. К ним относятся: – особая конструкция печей для получения печного газа; – повышенное содержание оксида серы (IV) в печном газе; – отсутствие стадии предварительной очистки печного газа. Последующие операции контактирования оксида серы (IV) по физико-химическим основам и аппаратурному оформлению не отличаются от таковых для процесса на основе колчедана и оформляются обычно по схеме ДКДА. Термостатирование газа в контактном аппарате в этом методе осуществляется обычно путем ввода холодного воздуха между слоями катализатора. Существует также способ производства серной кислоты из сероводорода, получивший название «мокрого» катализа, состоит в том, что смесь оксида серы (IV) и паров воды, полученная сжиганием сероводорода в токе воздуха, подается без разделения на контактирование, где оксид серы (IV) окисляется на твердом ванадиевом катализаторе до оксида серы (VI). Затем газовая смесь охлаждается в конденсаторе, где пары образующейся серной кислоты превращаются в жидкий продукт. Таким образом, в отличие от методов производства серной кислоты из колчедана и серы, в процессе мокрого катализа отсутствует специальная стадия абсорбции оксида серы (VI) и весь процесс включает только три последовательные стадии: 1. Сжигание сероводорода: Н2S + 1,5О2 = SО2 + Н2О – ΔН1, где ΔН1 = 519 кДж, с образованием смеси оксида серы (IV) и паров воды эквимолекулярного состава (1:1). 2. Окисление оксида серы (IV) до оксида серы (VI): SО2+ 0,5О2 <=> SО3 – ΔН2, где ΔН2 = 96 кДж, с сохранением эквимолекулярности состава смеси оксида серы (IV) и паров воды (1:1). 3. Конденсация паров и образование серной кислоты: SО3 + Н2О <=> Н2SО4 – ΔН3, где ΔН3 = 92 кДж таким образом, процесс мокрого катализа описывается суммарным уравнением: Н2S + 2О2 = Н2SО4 – ΔН, где ΔН = 707 кДж. Практика применения Серную кислоту применяют: - в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности - зарегистрирована в качестве пищевой добавки E513(эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров); - гидратации (этанол из этилена); - сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей); - алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др. Самый крупный потребитель серной кислоты - производство минеральных удобрений. На 1 т P2O3 фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH4)2SO4 - 0,75 т серной кислоты. C текущей ситуацией и прогнозом развития рынка серной кислоты можно познакомиться в отчетах Академии Конъюнктуры Промышленных Рынков «Рынок серной кислоты в России». www.newchemistry.ru | 