СЕРНАЯ КИСЛОТА: свойства, производство, применение

Она смешивается с водой в любых соотношениях со значительным выделением теплоты (образуются гидраты). В серной кислоте растворяется оксид серы. Такой раствор, состав которого характеризуется содержанием свободного SО3(100%-я H2SO4), называется олеумом.
ГОСТ 2184-77 является межгосударственным стандартом кислоты серной технической. Настоящий стандарт распространяется на техническую серную кислоту следующих видов: контактную (улучшенную и техническую); олеум (улучшенный и технический); башенную и регенерированную.
| Наименование показателя | Норма | ||||||||
| Контактная | Олеум | Башенная | Регенериро-ванная | ||||||
| Улучшенная | Техническая | Улучшенный | Технический | ||||||
| 1-й сорт | 2-й сорт | ||||||||
| 1. Исключен (Изм. № 3). |
| ||||||||
| 2. Массовая доля моногидрата (H2SO4), % | 92,5-94,0 | Не менее 92,5 | Не нормируется | Не менее 75 | Не менее 91 | ||||
| 3. Массовая доля свободного серного ангидрида (SO3), %, не менее | - | - | - | 24 | 19 | - | - | ||
| 4. Массовая доля железа (Fe), %, не более | 0,006 | 0,02 | 0,1 | 0,006 | Не нормируется | 0,05 | 0,2 | ||
| 5. Массовая доля остатка после прокаливания, %, не более | 0,02 | 0,05 | Не норми-руется | 0,02 | То же | 0,3 | 0,4 | ||
| 6. Массовая доля окислов азота (N2O3), %, не более | 0,00005 | Не нормируется | 0,0002 | Не нормируется | 0,05 | 0,01 | |||
| 7. Массовая доля нитро-соединений, %, не более | Не нормируется | 0,2 | |||||||
| 8. Массовая доля мышьяка (As), %, не более | 0,00008 | Не нормируется | 0,00008 | Не нормируется | |||||
| 9. Массовая доля хлористых соединений (Cl), %, не более | 0,0001 | Не нормируется | |||||||
| 10. Массовая доля свинца (Pb), %, не более | 0,001 | Не нормируется | 0,0001 | Не нормируется | |||||
| 11. Прозрачность | Прозрачная без разбавления | Не нормируется | |||||||
| 12. Цвет, см3 раствора сравнения, не более | 1 | 6 | Не нормируется | ||||||
Источник: ГОСТ 2184-77
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серосодержащие соединения, из которых может быть получена сера или непосредственно оксид серы (IV).
Природные залежи самородной серы невелики, хотя кларк ее равен 0,1 %. Чаще всего сера находится в природе в форме сульфидов металлов и сульфатов метало, а также входит в состав нефти, каменного угля, природного и попутного газов. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов.
Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV). При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает.
В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты.
Технология производства
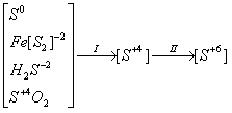
где I – стадия получения печного газа (оксида серы (IV)),
II – стадия каталитического окисления оксида серы (IV) до оксида серы (VI) и абсорбции его (переработка в серную кислоту).
В реальном производстве к этим химическим процессам добавляются процессы подготовки сырья, очистки печного газа и другие механические и физико-химические операции. В общем случае производство серной кислоты может быть выражено в следующем виде:
Сырье ![]() подготовка сырья
подготовка сырья ![]() сжигание (обжиг) сырья
сжигание (обжиг) сырья ![]()
![]() очистка печного газа
очистка печного газа ![]() контактирование
контактирование ![]() абсорбция
абсорбция
контактированного газа ![]() СЕРНАЯ КИСЛОТА
СЕРНАЯ КИСЛОТА
Конкретная технологическая схема производства зависит от вида сырья, особенностей каталитического окисления оксида серы (IV), наличия или отсутствия стадии абсорбции оксида серы (VI). В зависимости от того, как осуществляется процесс окисления SО2 в SО3, различают два основных метода получения серной кислоты. В контактном методе получения серной кислоты процесс окисления SО2 в SО3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SО3 + Н2О ![]() Н2SО4
Н2SО4
При проведении процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота. Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SО3 + N2О3 + Н2О ![]() Н2SО4 + 2NО
Н2SО4 + 2NО
Рассмотрим процесс получения серной кислоты контактным методом из двух видов сырья: серного (железного) колчедана и серы.
1) Химическая схема получения серной кислоты из колчедана включает три последовательные стадии:
- окисление дисульфида железа пиритного концентрата кислородом воздуха:
4FеS2 + 11О2 = 2Fе2S3 + 8SО2,
- каталитическое окисление оксида серы (IV) избытком кислорода печного газа:
2SО2 + О2 ![]() 2SО3
2SО3
- абсорбция оксида серы (VI) с образованием серной кислоты:
SО3 + Н2О ![]() Н2SО4
Н2SО4
По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным и состоит из нескольких последовательно проводимых стадий.
Обжиг колчедана в токе воздуха представляет собой необратимый некаталитический гетерогенный процесс, протекающий с выделением тепла через стадии термической диссоциации дисульфида железа:
2FеS2 = 2FеS + S2
и окисления продуктов диссоциации:
S2 + 2О2 = 2SО2
4FеS + 7О2 = 2Fе2S3 + 4SО2
что описывается общим уравнением
4FеS2 + 11О2 = 2Fе2S3 + 8SО2,
где ΔН = 3400 кДж.
Увеличение движущей силы процесса обжига достигается флотацией колчедана, повышающей содержание дисульфида железа в сырье, обогащением воздуха кислородом и применением избытка воздуха при обжиге до 30 % сверх стехиометрического количества. На практике обжиг ведут при температуре не выше 1000оС, так как за этим пределом начинается спекание частиц обжигаемого сырья, что приводит к уменьшению поверхности их и затрудняет омывание частиц потоком воздуха.
В качестве реакторов для обжига колчедана могут применяться печи различной конструкции: механические, пылевидного обжига, кипящего слоя (КС). Печи кипящего слоя отличаются высокой интенсивностью (до 10 000 кг/м2·сут), обеспечивают более полное выгорание дисульфида железа (содержание серы в огарке не превышает 0,005 мас. долей) и контроль температуры, облегчают процесс утилизации теплоты реакции обжига. К недостаткам печей КС следует отнести повышенное содержание пыли в газе обжига, что затрудняет его очистку. В настоящее время печи КС полностью вытеснили печи в других типов в производстве серной кислоты из колчедана.
2) Технологический процесс производства серной кислоты из элементарной серы контактным способом отличается от процесса производства из колчедана рядом особенностей. К ним относятся:
– особая конструкция печей для получения печного газа;
– повышенное содержание оксида серы (IV) в печном газе;
– отсутствие стадии предварительной очистки печного газа.
Последующие операции контактирования оксида серы (IV) по физико-химическим основам и аппаратурному оформлению не отличаются от таковых для процесса на основе колчедана и оформляются обычно по схеме ДКДА. Термостатирование газа в контактном аппарате в этом методе осуществляется обычно путем ввода холодного воздуха между слоями катализатора.
Существует также способ производства серной кислоты из сероводорода, получивший название «мокрого» катализа, состоит в том, что смесь оксида серы (IV) и паров воды, полученная сжиганием сероводорода в токе воздуха, подается без разделения на контактирование, где оксид серы (IV) окисляется на твердом ванадиевом катализаторе до оксида серы (VI). Затем газовая смесь охлаждается в конденсаторе, где пары образующейся серной кислоты превращаются в жидкий продукт.
Таким образом, в отличие от методов производства серной кислоты из колчедана и серы, в процессе мокрого катализа отсутствует специальная стадия абсорбции оксида серы (VI) и весь процесс включает только три последовательные стадии:
1. Сжигание сероводорода:
Н2S + 1,5О2 = SО2 + Н2О – ΔН1, где ΔН1 = 519 кДж,
с образованием смеси оксида серы (IV) и паров воды эквимолекулярного
состава (1:1).
2. Окисление оксида серы (IV) до оксида серы (VI):
SО2+ 0,5О2 <=> SО3 – ΔН2, где ΔН2 = 96 кДж,
с сохранением эквимолекулярности состава смеси оксида серы (IV) и паров
воды (1:1).
3. Конденсация паров и образование серной кислоты:
SО3 + Н2О <=> Н2SО4 – ΔН3, где ΔН3 = 92 кДж
таким образом, процесс мокрого катализа описывается суммарным уравнением:
Н2S + 2О2 = Н2SО4 – ΔН, где ΔН = 707 кДж.
Практика применения
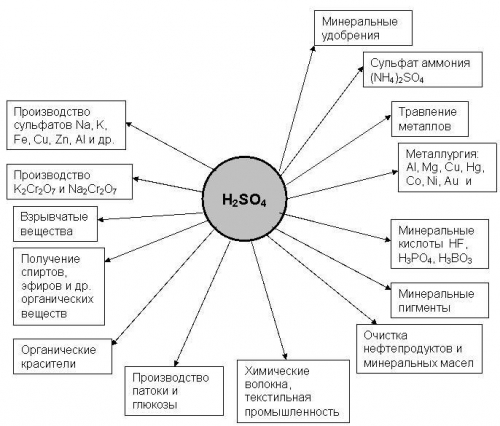
Серную кислоту применяют:
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности - зарегистрирована в качестве пищевой добавки E513(эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Самый крупный потребитель серной кислоты - производство минеральных удобрений. На 1 т P2O3 фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH4)2SO4 - 0,75 т серной кислоты.
C текущей ситуацией и прогнозом развития рынка серной кислоты можно познакомиться в отчетах Академии Конъюнктуры Промышленных Рынков «Рынок серной кислоты в России».
www.newchemistry.ru