
Для осуществления этого проекта инвестор и руководство МГУ в лице ректора В.А. Садовничего и деканов биомедицинских факультетов приняли решение пойти по пути, достаточно распространенному на Западе, но все еще необычному для России — создать «приуниверситетскую» биотехнологическую компанию. Так была создана «Митотехнология», уже три года ведущая проект «Практическое использование ионов Скулачева». Это один из немногих случаев, когда научные разработки могут быть внедрены в практик. «Роснано» намерена вложить 710 миллионов рублей в производство инновационных лекарственных препаратов против возрастных заболеваний на основе «ионов Скулачева». Общий же бюджет проекта, уже одобренного наблюдательным советом «Роснано», составит до 1,8 миллиарда рублей. «Финансирование будет проходить в несколько этапов, в зависимости от результатов клинических испытаний, которые были начаты в конце 2009 года. Вывод на рынок офтальмологических препаратов запланирован на 2013 год, препаратов системного действия – на 2016 год. Ожидаемые доходы проекта к 2016 году могут составить до 8,439 миллиарда рублей за счет организации производства в России и лицензирования технологии иностранным производителям», – говорится в сообщении. В России проектная компания планирует организовать производство лекарственной субстанции, из которой на контрактной основе будут изготавливаться готовые лекарственные формы. Выход на международный рынок планируется осуществить через лицензирование технологии производства зарубежным компаниям. «Разработанные препараты уменьшают возрастные изменения в тканях на всех стадиях старения. Доклинические исследования демонстрируют существенное снижение смертности животных в среднем возрасте и за счет этого – увеличение средней продолжительности жизни. Максимальная продолжительность жизни увеличивается незначительно, однако животные остаются активными почти до самой смерти, не проявляя типичных признаков старения. Это свойство митохондриальных антиоксидантов дает возможность создать на их основе препараты от ряда опаснейших возрастных заболеваний. Они помогают бороться именно с возрастными изменениями, а не со смертностью в очень старом возрасте», – приводит пресс-служба слова научного руководителя проекта, академика РАН, директора НИИ физико-химической биологии им. Белозерского МГУ Владимира Скулачева. Причины болезни Борьба со старением — задача масштабная и не под силу какой-то одной научной группе. По сложности она сопоставима с проектом С.П. Королева по запуску первого спутника или «всемирным проектом» по расшифровке генома человека. Над решением этой задачи в мире бьются сотни лабораторий, включая Национальный институт старения США. К настоящему моменту существует более 300 научных теорий старения. Существует множество теорий старения. Наиболее распространенной и убедительной из них считается свободно-радикальная гипотеза Д. Хармана, предположившего, что ведущую роль в ослаблении жизненных функций с возрастом играет окисление биополимеров активными формами кислорода (АФК). В соответствии с этой гипотезой было установлено, что при старении возрастает уровень окисленности ДНК, белков и липидов. Подобная ситуация может быть следствием увеличения в старости продукции АФК или ослаблении антиооксидантной защиты, либо просто длительности повреждающего воздействия АФК, пропорционального возрасту организма. Одним из крупнейших открытий последних десятилетий стало обнаружение «программ смерти». Было установлено, что гибель клетки происходит, как правило, в результате выполнения одной из таких программ (апоптоза или некроза, а также их комбинации), заложенных в ее геноме. Гипотеза Д. Хармана вместе с этим открытием послужила основанием для заключения, что, по крайней мере, одноклеточные организмы располагают механизмом самоликвидации. Было показано, что аналогичные «программы смерти» существуют у бактерий и одноклеточных эукариот, таких как, например, дрожжи. Существует множество примеров, доказывающих, что запрограммированная смерть особи процесс, названный «феноптозом» (процесс был так назван академиком В.П. Скулачевым, слово придумано и введено в обиход академиком, лингвистом М.Л. Гаспаровым. — Прим. ред), присущ также и высшим организмам — животным и растениям, хотя его молекулярные механизмы еще только предстоит выяснить. Биологический смысл феноптоза достаточно очевиден по аналогии с апоптозом — очищение популяции от нежелательных особей с целью защиты всей популяции, в случае если они несут для нее угрозу. Другой функцией феноптоза могло бы быть ускорение смены поколений. Концепция феноптоза заставляет по-другому взглянуть на проблему старения. Что, если это тот способ, которым природа заставляет нас уходить, освобождая место молодым? Что, если это медленное угасание, также как и программа апоптоза, заложено в виде генетической программы в нашем геноме, и его основным биологическим смыслом является ускорение эволюции? Эти вопросы позволили нам сформулировать теорию запрограммированного старения как инструмента эволюции. Чем глубже биологи проникают в механизм функционирования живых систем, тем больше они убеждаются, что природа старается держать под строжайшим контролем все процессы, идущие в организме, особенно связанные с его развитием, с наследственностью. В этой связи представляется особенно невероятным, что природа отдала такой важнейший этап, как старение и смерть организма, на откуп случайным обстоятельствам и не запрограммировала в геноме управление этим процессом. МЕХАНИЗМ ДЕЙСТВИЯ МИТОХОНДРИАЛЬНО-АДРЕСОВАННЫХ АНТИОКСИДАНТОВ 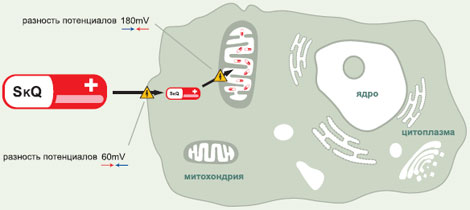
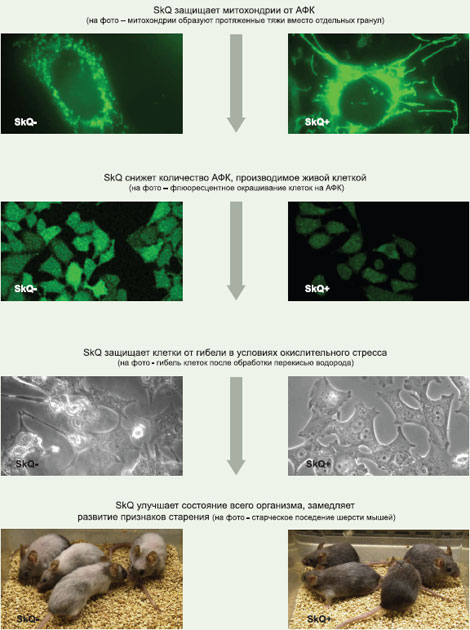
Подход к лечению болезни Теория старения как медленного феноптоза дает нам шанс. Если существует программа, медленно, но верно ведущая нас к смерти, то, возможно, в нее можно вмешаться, перенастроить ее, замедлить, сломать. К сожалению, на данном этапе развития биоинженерия еще не вполне созрела для создания новых биологических систем, биохимических путей и т.п. Но ломать всегда проще, чем строить. Сейчас наука располагает мощнейшим арсеналом средств, позволяющих останавливать реализацию самых разных генетических программ. Почему бы не добавить в их список и программу старения? Речь не идет об изменении генома — сегодня человек еще не готов к вмешательству в собственные гены. Биология не в силах предсказать все последствия такого шага, т.к. он может быть необратим для организма. Остается фармакологический подход — разработка вещества, способного не столько изменить саму программу старения, сколько помешать ее реализации, действуя на определенную мишень — какой-то элемент, процесс в клетке или организме, принципиально важный для работы вредоносной программы. Где искать эту мишень? Здесь необходимо вернуться к гипотезе Д. Хармана. Безусловно, активные формы кислорода (АФК) — подходящие кандидаты на роль «самурайского меча», используемого организмом, решившим совершить биохимическое самоубийство. Даже если они и не являются прямой причиной старения, то, безусловно, принимают непосредственное участие в этом процессе. В клетке существует множество различных АФК, которые выполняют самые разные (и не всегда вредные) функции. Где же искать те, что участвуют в процессах старения? В клетке существует целый набор ферментов, превращающих О2 в первичную форму АФК — супер-оксид (О2*-) или в его производное — перекись водорода. Однако все они по мощности значительно уступают дыхательной цепи внутренней мембраны митохондрий. За день митохондрии взрослого человека поглощают около 400 л О2, превращая его в воду путем четырехэлектронного восстановления. Однако, если хотя бы 0,1% этого количества О2 будет восстановлено химически более простым, одноэлектронным образом, то получится 0,4 л О2*-, что намного превышает возможности всех прочих механизмов генерации АФК, вместе взятых. Фактически мы носим в своих митохондриях потенциальный генератор сильнейшего яда, который легко может убить наши клетки и нас самих вместе с ними. Такая катастрофа произойдет даже не из-за прямого токсического действия АФК, а вследствие запуска процессов апоптоза или некроза, мощными индукторами которых служат АФК.
|
