Механизм действия VCI
Летучие ингибиторы коррозии обычно представляют собой порошок. Термин «летучие» относится только к механизму переноса активного компонента из носителя (плёнки, бумаги и т.п.) к поверхности металлического изделия. Испарение активного компонента из плёнки происходит до момента достижения равновесия, определяемого парциальным давлением. Пары ингибитора коррозии достигают поверхности изделия, мигрируют через слой электролита (либо высаживаются в виде микрокристаллов, а потом растворяются при попадании влаги) и адсорбируются на металлической поверхности, образуя гидрофобный слой, отделяющий металл от электролита. 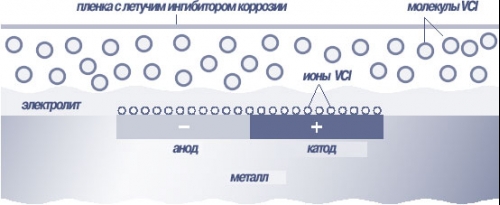
Рисунок 1. Механизм действия VCI
Летучие ингибиторы коррозии в основном представляют собой продукт реакции слабого основания (амины и их производные) и слабой органической кислоты. В результате таких реакций получаются различные карбоксилаты. Эффективность ингибитора коррозии возрастает с увеличением длины углеводородного радикала органической кислоты, что связано с увеличением гидрофобности слоя. Существует некий набор стандартных продуктов этой группы, эффективность которых подтверждена промышленными испытаниями: • Циклогексиламин и его производные (карбонаты, бензоаты) • Дициклогексиламин и его производные (карбонаты, бензоаты) • Гуанидин и гуанидин хромат • Морфолин • Бензиламин • Аминоспирты и соли других первичных, вторичных, третичных аминов и их производных
С определенным упрощением процесс электрохимической коррозии может быть представлен следующим образом:
1. анодный процесс - ионизация атомов металла с образованием ионов (гидратированных) в растворе и нескомпенсированных электронов в металле; 2. процесс переноса электронов в металле от зон анодной реакции к участкам, на которых термодинамически и кинетически возможен катодный процесс; 3. процесс подвода окислителя-деполяризатора к катодным зонам; 4. катодный процесс - ассимиляция избыточных электронов деполяризатором, для которого в этих зонах обеспечены термодинамические условия процесса восстановления. При изменении концентрации (плотности) положительных или отрицательных частиц в растворе или металле может измениться скорость процесса растворения металла. При уменьшении, например, концентрации деполяризатора, у катодной зоны может оказаться, что катодная реакция деполяризации термодинамически невозможна. Было доказано, что гидроксильные ионы и анионы кислот, образующиеся при диссоциации и гидролизе аминов и их солей определяют тип замедления процесса коррозии - анодный или катодный механизм. Ингибирующий эффект таких соединений обусловлен присутствием в их структуре циклических катионов, содержащих азот. По некоторым данным азот способен образовывать координационные связи с металлом, что значительно улучшает адсорбцию. Адсорбция катионов увеличивает перенапряжение ионизации и замедляет процесс коррозии. Замедление катодного процесса достигается путём введения в органическую молекулу ингибитора неорганических окисляющих анионов. Такие анионы в сочетании с бензольным кольцом очень хорошо восстанавливаются на металлическом катоде. Хорошо известно, что нитриты и бензоаты способны замедлять анодные реакции. Некоторые соединения, в особенности соли аминов и замещённой бензойной кислоты, эфиры хромовой кислоты способны замедлять кинетику катодных реакций, будучи, помимо этого, эффективными анодными ингибиторами. Результаты исследований подтверждают значительное снижение скорости анодных реакций в присутствии аминов и их солей, причём эффективность чистых аминов существенно выше, чем их солей.
| 