Мировые инвестиции в научные исследования и разработки в области сохранения здоровья определяются несколькими странами. Доля США составляет 49% мировых расходов, за ними следуют Япония (13%), Великобритания (7%), Германия (6%) и Франция (5%). С середины 1980-х в США капиталовложения в научные исследования и разработки в области здравоохранения составляют постоянно увеличивающуюся часть затрат на научные исследования и разработки, связанные с космосом, энергетикой, природными ресурсами/окружающей средой и наукой. 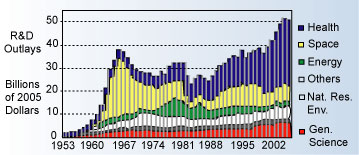
Капитальные затраты на научные исследования и разработки из бюджета правительства США 1953-2006 г.
Рост затрат на здравоохранение отражает растущее понимание важности роли исследования здоровья в решении задач здравоохранения. Нормативы по медицинским приборам: введение
Медицинские приборы являются одной из наиболее строго регулируемых групп продуктов, производимых в мире. Во всех странах основных рынков внедрение на рынок нового медицинского прибора требует соблюдения целого ряда комплексных нормативных требований. Однако такие нормативные требования зачастую создают множество проблем компаниям, старающимся преодолеть путаницу соответствия бесчисленным требованиям при внедрении прибора на различные рынки мировой экономики.
Независимо от того, находятся ли производители медицинских приборов в начале процесса регулятивного производства, подготавливая документы на соответствие американским стандартам качества FDA, канадской системе оценки качества медицинских приборов CMDCAS, японской системе сертификации JPAL, китайской системе оценки качества медикаментов SFDA, директивам ЕС, или другие нормативные документы, разрабатывают ли они техническую информацию и пакет проектной документации для маркировки о соответствии действующим директивам/стандартам ЕС для данного класса изделий (стандарт СЕ) либо планируют внутренний аудит, существуют международные консультационные компании с глубоким знанием норм по медицинским приборам и техническим опытом, которые оказывают помощь и поддержку компаниям по различным требованиям в целях эффективного и рентабельного вывода медицинской продукции на рынок. Нормативы США по применению медицинских приборов
В Соединенных Штатах Америки ответственность за контроль фирм, осуществляющих производство, смену упаковки, изменение маркировки и/или импорт медицинских приборов, продающихся на территории США, несет Центр по контролю над оборудованием и радиационной безопасностью (CDRH), являющийся подразделением Управления по контролю за продуктами и лекарствами.
Медицинский прибор определяется Законом о пищевых продуктах, лекарственных препаратах и косметических средствах как «…инструмент, аппарат, оборудование, механизм, устройство, имплантат, лабораторный химический препарат или аналогичный либо взаимосвязанный объект, включая комплектующие детали или приспособления, который: признан Национальным Формуляром или Фармакопеей США либо их любым приложением, предназначен для применения при диагностировании заболевания или других состояний либо лечения, облегчения, терапии или предотвращения заболевания человека или животных, и который не достигает изначально определенных целей путем химического взаимодействия внутри организма человека или животного или на нем, а также который для достижения изначально определенной цели не находится в зависимости от участия в обмене веществ».
Существует три нормативных класса медицинских приборов, присваиваемых по степени риска, которую такой прибор представляет для пациента и уровню нормативного контроля, который, по определению Управления по контролю за продуктами и лекарствами (FDA), требуется для осуществления маркетинга прибора на законных основаниях. Классификация предусматривает наличие Класса I, Класса II и Класса III по степени риска для пациента при увеличении нормативного контроля от Класса I к Классу III. Приспособления для медицинских приборов и оборудование, используемое с медицинскими приборами для обеспечения действия таких приборов, имеют классификацию, аналогичную классификации медицинских приборов. Медицинские приборы Класса I представляют минимальный потенциальный вред для пользователя и требуют наименьшего нормативного контроля. Такие приборы, например, смотровые перчатки, перевязь для сломанной руки, ручные хирургические инструменты, как правило, просты в конструкции/производстве и обладают доказанной безопасностью в применении. К Классу II относятся приборы, для гарантии безопасности и эффективности которых недостаточно общих процедур контроля, при этом существующие методы могут обеспечить такие гарантии. Помимо соответствия общим процедурам контроля приборы Класса II проходят специальный контроль. Примерами приборов Класса II являются механические инвалидные кресла, инфузионные насосы и хирургические простыни. Приборы Класса III, как правило, применяются для поддержания или обеспечения жизни человека, имеют существенное значение для предотвращения нанесения вреда здоровью человека либо представляют собой потенциальный риск заболевания или вред для пациента. Большинство приборов Класса I освобождаются от Предпродажного уведомления; большинство приборов Класса II требуют Предпродажного уведомления и большинство приборов Класса III требуют Предпродажного испытания.
Все три класса медицинских приборов проходят Общие процедуры контроля и основные нормативные требования, которым должны соответствовать производители приборов, распространяемых на территории США. Такими Общими процедурами контроля являются:
- Регистрация организаций (FDA-2891) производителями, дистрибьюторами, производителями повторной упаковки и маркировки. На иностранные организации требования по регистрации в FDA не распространяются.
- Внесение приборов, подлежащих реализации, в Список медицинских приборов FDA (FDA-2892).
- Система контроля качества (QS). Производство приборов в соответствии с Надлежащей производственной практикой.
- Требования к маркировке в соответствии с нормативами маркировки, указанными в 21 CFR Часть 801 или 21 CFR 809.
- Подача предпродажного уведомления перед маркетингом прибора.
Помимо выполнения Общих процедур контроля и подачи предпродажного уведомления приборы Класса II должны также пройти специальный контроль, который может предусматривать особые требования к маркировке, обязательные стандарты технических характеристик и послепродажный надзор. Класс III является наиболее строгой нормативной категорией приборов. Для обеспечения гарантии безопасности и эффективности приборов Класса III недостаточно информации, предоставленной в процессе общих процедур контроля или специального контроля.
Для обеспечения безопасности и эффективности приборов Класса III требуется проведение процесса научного анализа предпродажного испытания прибора. Не всем приборам Класса III необходимо наличие утверждения предпродажного испытания для реализации на рынке. Заявление на утверждение предпродажного испытания для последующей реализации на рынке подается для следующих приборов: регламентированные как новые лекарственные средства до 28 мая 1976 года, также называемые «переходные приборы»; приборы, в которых обнаружены существенные несоответствия с приборами, реализованными до 28 мая 1976 года; и устаревшие приборы Класса III, для которых согласно нормативу 21 CFR требуется заявление на предпродажное испытание. Нормативы Канады по применению медицинских устройств
В Канаде контроль медицинских приборов осуществляется департаментом здравоохранения Канады Health Canada/Santé Canada. Управление по терапевтическим продуктам является федеральным органом, регулирующим фармацевтическую продукцию и медицинские приборы, применимые к человеку. 1 июля 1998 года в Канаде вошли в силу новые правила и нормы относительно медицинских приборов, регулирующие продажу, импорт и рекламу медицинских приборов. Новые правила устанавливают систему классификации медицинских приборов на основе риска, где Класс I предусматривает минимальный риск, а Класс IV – максимальный. Устройство классифицируется производителем в соответствии с нормативами. Система классификации имеет некоторые отличия от системы, действующей на территории Европейского Сообщества или США, но в целом эти системы схожи. По мере повышения уровня риска прибора требуются дополнительные данные для подтверждения его безопасности и эффективности.
Согласно Канадским нормативам по медицинским приборам в качестве обязательного условия лицензирования медицинских приборов требуется специальный системный стандарт, впервые определяемый национальным контролирующим органом (Health Canada). Согласно требованиям системы качества (разделы 32 (2) (f), 32 (3) (j) и 32 (4) (p)), предусмотренным Канадскими нормативами по медицинским приборам, измененными и действующими с 1 января 2003 года, все производители медицинских приборов соответствующих Классов II, III, IV, реализуемых на канадском рынке, для получения лицензии на продажу медицинского прибора на канадском рынке должны получить и представить действующие свидетельства ISO 13485 или ISO 13488, выпущенные Регистратором CMDCAS, имеющим квалификацию SCC. Также производители должны представить соответствующее свидетельство со своими ежегодными заявлениями на продление. В июле 2003 года Канада приняла новый стандарт ISO 13485:2003, поэтому теперь все держатели свидетельств ISO 13485 должны перейти на новый стандарт до 14 марта 2006 года. Канадская система оценки качества медицинских приборов (CMDCAS) была разработана Health Canada совместно с Канадским советом по стандартам (SCC) для обеспечения действия правил Канадских нормативов по медицинским приборам. Дон Росато
http://www.omnexus.com |
