БИОМАКРОМОЛЕКУЛА и НАНОЧАСТИЦА (часть I)
Большое разнообразие материалов, из которых можно изготовить ядра частиц, в сочетании со способностью создавать свои собственные поверхностные свойства делает наночастицы, защищенные молекулярным монослоем, прекрасной основой для целевого воздействия на биомакромолекулы. В настоящем обзоре мы рассмотрим последние достижения в области взаимодействия биомакромолекул и наночастиц, уделяя особое внимание контролю биомакромолекулярной структуры и функционирования с помощью создаваемых взаимодействий с поверхностями наночастиц.
Распознавание биомакромолекулярных поверхностей искусственными рецепторами обеспечивает возможность регулирования биомакромолекулярных взаимодействий, включая взаимодействия: белок-углевод, белок-белок, и белок-нуклеиновая кислота. Такое распознавание может служить инструментом контролирования клеточных и внеклеточных процессов для терапевтических применений, а также открывать новые направления для биологического контроля параметров и клинической диагностики (рис. 1).
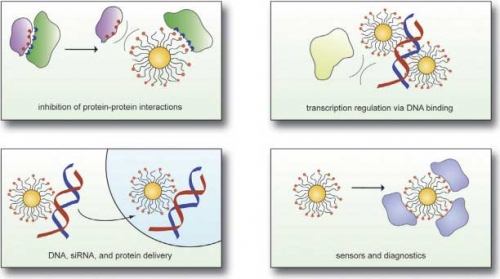
Рис. 1. Области применения, ставшие возможными благодаря взаимодействиям биомолекул с наночастицами (угнетение взаимодействий белок-белок, регулирование транскрипции через связывание ДНК, доставка ДНК, siРНК и белка, датчики и диагностика).
Распознавание биомолекулярных поверхностей связано с некоторыми проблемами из-за их размера и сложности. Существует две основные проблемы, которые надо преодолеть для того, чтобы осуществить специфическое/селективное распознавание наночастицами биомакромолекулярной поверхности (рис. 2). Во-первых, для высокоаффинного связывания необходима большая площадь поверхности, из-за выпуклой формы связывающей поверхности, сочетающейся с белковой поверхностью, открытой для воздействия растворителя. Исследование взаимодействия белок-белок показывают, что в таких взаимодействиях, как правило, участвуют поверхности с площадью >6 нм2 на белок. Другой проблемой является предварительная организация, при которой для эффективного и селективного взаимодействия необходима хорошо определенная в структурном отношении поверхность.
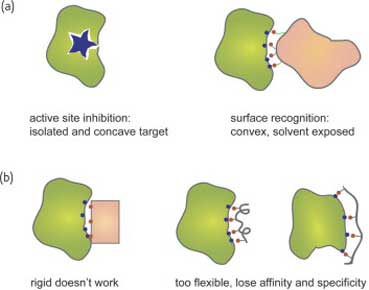
Рис. 2. Проблемы, возникающие при поверхностном распознавании биомакромолекул. (a) Необходима большая площадь поверхности. (b) Предварительно организованный и в то же время гибкий рецептор.
Клеточные каркасы с большими поверхностями представляют особый интерес для биомолекулярного распознавания. Кластеры с защитным монослоем (monolayer-protected clusters – MPC) и смешанные MPC (mixed MPC – MMPC), где металлические ядра многогранной формы, непосредственно окруженные самособирающимся монослоем, являются многообещающими материалами для создания биомакромолекулярных рецепторов. Можно легко создавать наночастицы с размерами от 1,5 нм до >10 нм, сопоставимые с белками и другими биомакромолекулами (рис. 3), обеспечивая большую площадь поверхности для взаимодействия. Во-вторых, образованный самосборкой монослой на поверхности частицы обеспечивает предварительную организацию присоединенных распознающих элементов. Кроме того, множество металлических и полупроводниковых материалов ядра, которые легко доступны, обеспечивают возможность использования замечательных оптических, электронных и магнитных свойств. Тем не менее, использование этих свойств при селективном распознавании биомакромолекул требует тщательной подгонки под заданные свойства функций поверхности, цель, которая может быть достигнута за счет использования комплексного подхода.
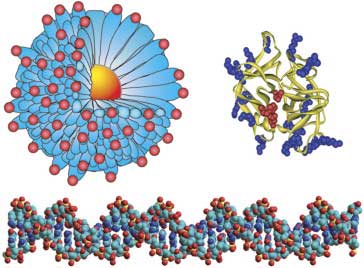
Рис. 3. Схематическое изображение 2 нм наночастицы золота с монослоем из 11-меркаптоундекановой кислоты и относительные размеры α-химотрипсина и двойной спирали ДНК.
Основное внимание в целом ряде недавно опубликованных обзорных статей о взаимодействиях наночастиц и биомакромолекул было уделено либо биологическому, либо диагностическому применениям. Здесь мы уделяем основное внимание последним достижениям в области использования поверхностей наночастиц для распознавания ДНК и белка. В то время как биомакромолекулы, такие как нуклеиновая кислота и белки, были пересажены на наночастицы для контролируемого изменения поверхностей и создания новых приборов, мы в настоящем обзоре останавливаемся на использовании наночастиц с защитным монослоем, используемых в качестве многовалентных рецепторов. В частности, здесь рассматривается нековалентное взаимодействие биомакромолекулы и наночастицы с точки зрения изменения структуры и функции биомакромолекул.
Создание наночастиц с защитным монослоем
Введение органических лигандов в покрытие наночастиц расширяет возможности их использования за счет предотвращения агрегации и агломерации. Такие лиганды могут также наделить наночастицы существенными способностями к распознаванию, транспортировке и катализу. MPC могут создаваться из множества металлических и полупроводниковых материалов, сплавов и оксидов, причем не существует процедуры, общей для всех материалов. Ядерные материалы не только создают платформу для закрепления организованных органических слоев, но также придают уникальные физические свойства, например, уникальные оптические свойства наночастиц золота и серебра за счет поверхностного плазмонного резонанса. К числу других полезных материалов относятся высоко люминесцентные полупроводниковые квантовые точки (quantum dots – QD) и частицы металлов и оксидов, обладающие магнитной активностью. Свойства некоторых материалов, используемых для образования ядер, и соответствующих лигандов сведены в таблицу 1.
Таблица 1. Различные металлические и полупроводниковые материалы, используемые в качестве наноразмерных платформ.
Материал ядра | Свойства | Лиганд |
| Au, золото | Поглощение, тушение флуоресценции, стабильность | Тиол, дисульфид, фосфин |
| Ag, серебро | Усиленная поверхностью флуоресценция | Тиол, амин |
| Pt, платина | Каталитическая активность | Тиол, фосфин, амин, изоцианид |
| CdSe, селенид кадмия | Люминесцентность, фотостабильность | Тиол, фосфин, пиридин |
| Fe2O3, оксид железа (III) | Магнитные свойства | Диол, производные допамина, амин |
| SiO2, оксид кремния | Биологическая совместимость | Алкоксисиланы |
Еще в 1951 г., Туркевич проводил восстановление солями лимонной кислоты HAuCl4 золота в виде коллоидного раствора в воде. Этот подход был усовершенствован Френсом для оптимизации размера частиц за счет изменения соотношения реагентов (рис. 4). Этот метод обычно использовался для приготовления умеренно полидисперсных сферических наночастиц золота с диаметрами от 10 до 20 нм. Было показано, что дигестивное созревание, т. е. нагревание коллоидной суспензии в растворителях с высокими температурами кипения в присутствии алкантиолов или других веществ, стимулирующих дигестивное созревание, может значительно уменьшить средний размер частиц и полидисперсность. Такие подходы с использованием созревания были успешно использованы для получения возможности кинетического управления размером, формой и распределением по размерам металлических, а также и полупроводниковых наночастиц. Брюст со своими коллегами разработал более универсальный метод создания металлических наночастиц, основанный на восстановлении металлической соли в присутствии лигандов покрытия (рис. 4). Размер частиц, получаемых в результате данного процесса, контролируется с помощью изменения соотношения металл/лиганд и условий протекания реакции. С помощью подобных процедур востановления были получены многие наночастицы, такие металлов как Ag, Pt, Pd, и Cu.
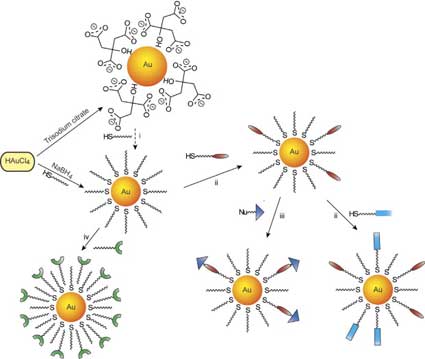
Рис. 4. Создание MPC и MMPC путем восстановления цитратом или методом Брюста и последующая модификация: дигестивное созревание (i), реакция обмена Мюррея (ii), нуклеофильная реакция (iii), инкапсуляция гидрофобных MPCs в поверхностно-активные мицеллы (iv).
Возможность биологического применения MPC требует поверхностной функциональности и растворимости в воде. Наиболее часто используемым методом является процесс обмена местами (рис. 4), введенный Мюрреем и др. При обмене местами исходные лиганды на поверхности наночастицы заменяются внешними, функционализированными лигандами. Дополнительную функциональность можно ввести с помощью традиционных органических процедур. И, наконец, можно использовать процедуру самосборки для модификации поверхностей частиц. В последнее время были произведены растворимые в воде функционализированные наночастицы за счет включения гидрофобных наночастиц в гидрофобную внутреннюю часть поверхностно-активных мицелл.
Заряженные или гидрофильные частицы часто вводят на поверхность наночастицы, чтобы обеспечить растворимость в воде и функциональность для взаимодействия с биомолекулами. Гидрофильные группы, такие как олиго(этиленгликоль) (OEG) и поли(этиленгликоль) (PEG), обычно внедряют в монослои для улучшения растворимости MMPC в воде; здесь имеется также дополнительное преимущество, благодаря устойчивости OEG и PEG к неспецифическим взаимодействиям с биомакромолекулами, повышается биологическая совместимость MMPC. Многослойное покрытие, состоящее из гидрофобной внутренней части, слоя OEG, и элементов распознавания на поверхности, обеспечивает наличие особенно полезных структур для контролируемых биомолекулярных взаимодействий (рис. 5).
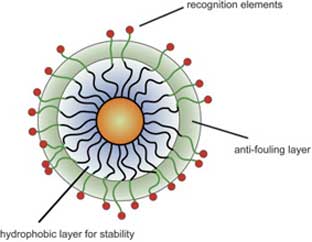
Рис. 5. Многофункциональные монослои частицы с гидрофобной внутренней частью для обеспечения стабильности, промежуточным слоем гидрофильных групп для обеспечения биологической совместимости, и элементами распознавания на поверхности для взаимодействия с биомолекулами.
Взаимодействие наномолекул и ДНК
Считывание кода (транскрипция) ДНК является важным биологическим процессом, благодаря которому последовательность ДНК ферментно копируется полимеразой РНК для производства комплементарной РНК, дающей возможность передачи генетической информации, необходимой для синтеза белка. Поэтому связывание ДНК и угнетение транскрипции является мощным инструментом управления поведением клеток. Известно три вида связывания ДНК, включая поверхностное связывание, связывание по бороздкам ДНК и внедрение. На основе этих трех механизмов взаимодействия некоторое количество небольших молекул использовали, чтобы связывать специальные последовательности ДНК и ингибировать или активировать транскрипцию ДНК. Наночастицы с защитным монослоем представляют собой привлекательные платформы для связывания нуклеиновых кислот, которые дают большую площадь контакта, а также многовалентные взаимодействия со связыванием ДНК, напоминающие происходящие естественным путем взаимодействия белка и нуклеиновых кислот.
Прививание соответствующих катионных лигандов на поверхность наночастицы обеспечивает ДНК эффективными рецепторами. В качестве примера можно привести работу Ротелло и его коллектива, которые использовали катионные MMPC (такие как 1 на рис. 6) для создания комплекса с двойной спиралью ДНК. Такие смешанные кластеры с защитным монослоем взаимодействуют с ДНК с помощью электростатического притяжения положительно заряженных головных групп и отрицательно заряженной ДНК. Добавление ДНК к раствору MMPC (1 на рис. 6) приводит к созданию дискретных комплексов со стехиометрией MMPC (1) – ДНК, равной 4:1. Связывание MMPC (1) с ДНК препятствует транскрипции ДНК T7 РНК полимеразой.
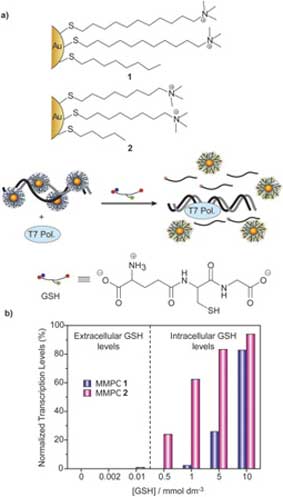
Рис. 6. (a) Схематическое изображение ингибирования и реактивации с глютатионом в качестве посредника при транскрипции ДНК. (b) Объем выхода РНК, обнаруженный относительно объема, произведенного в отсутствие MMPC при различных концентрациях глютатиона
Существенным также является тот факт, что монослойные структуры могут использоваться для регулирования стабильности наночастиц, что представляет особый интерес для применений, связанных с высвобождением и доставкой. Хэн и др. использовали внутриклеточные скопления глютатиона (GSH) для восстановления транскрипции катионной ДНК связанной с наночастицей (рис. 6а). Катионные наночастицы золота (1) и (2) полностью угнетают транскрипцию ДНК T7 РНК-полимеразой (смотри выше). Как показано на рисунке 6 b, комплексы ДНК-MMPC стабильны при внеклеточных уровнях GSH (например, <10 мкмоль/дм3), но при внутриклеточных уровнях глютатиона (10-500 мкмоль/дм3) появляется зависящее от дозировки восстановление транскрипции ДНК. Такое восстановление деятельности возникает из-за обмена местами катионных остатков наночастиц с анионными GSH, что уменьшает общий положительный заряд частиц и соответственно уменьшает его электростатическое притяжение по отношению к основной цепи ДНК. Эти исследования показывают, что высвобождение ДНК и восстановление ее транскрипции могут регулироваться как с помощью выбора монослойного покрытия, так и с помощью внутриклеточных уровней содержания GSH.
Помимо этого для осуществления ортогонального высвобождения ДНК in vitro и в клетках использовались фотохимические методы. Для того чтобы обеспечить и высвобождение, и транспортировку ДНК в модульном виде, Хэн с группой сотрудников разработали фотолабильную наночастицу MMPC (3), которую можно преобразовывать из катионной в анионную MMPC (4) при воздействии светового излучения (рис. 7.).
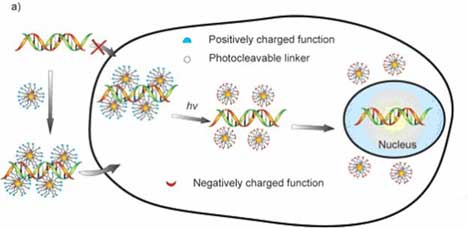
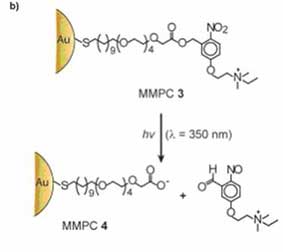
Рис. 7. (a) Схематическое изображение высвобождения ДНК из MMPC (3) – ДНК комплекса при воздействии ультрафиолетового излучения внутри клетки. (b) Схематическое изображение трансформации под воздействием светового излучения катионного MMPC (3) в анионный MMPC (4).
ССЫЛКИ:
Биомакромолекула и наночастица: взаимодействие с белками и перспективы (часть II)
Чанг-Ченг Ю, Апиват Чомпоосор и Винсент М. Ротелло, Химический Факультет Массачусетского Университета, США