НОВОСТИ ОРГАНИЧЕСКОЙ ХИМИИ
В этом дайджесте: получение реакционноспособных полимеров с помощью обратимой реакции Дильса-Альдера; агрегация комплексов рения эффективно испускает свет в видимой области; органокатализируемое алкилирование с помощью солей трехфторборной кислоты; превращения ненасыщенных серосодержащих краун-эфиров и энантиоселекстивное присоединение нитрометана к альфа-кетоэфирам.

Здесь: получение реакционноспособных полимеров с помощью обратимой реакции Дильса-Альдера; агрегация комплексов рения эффективно испускает свет в видимой области; органокатализируемое алкилирование с помощью солей трехфторборной кислоты; превращения ненасыщенных серосодержащих краун-эфиров и энантиоселекстивное присоединение нитрометана к альфа-кетоэфирам.
Реакционноспособные группы, находящиеся в боковых ответвлениях полимерной цепи могут оказаться весьма полезными для получения высокофункционализированных материалов, однако синтез таких материалов представляет собой непростую задачу, так как реакционноспособные группы не должны менять структуру в процессе полимеризации.
Диспинар (T. Dispinar) и соавторы из Университета Богазичи (Стамбул) сообщают о получении функционализированных метилакрилатных полимеров, содержащих высокореакционноспособные малеинимидные боковые фрагменты. [1].
Для получения защищенного малеинового ангидрида 1 исследователи использовали реакцию Дильса-Альдера малеинового ангидрида и фурана. Взаимодействие 1 с 3-амино-1-пропанолом, а затем с хлорангидридом метакриловой кислоты позволяет получить мономер 2.
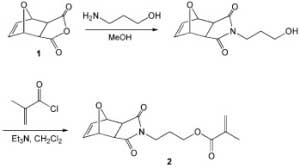
Рисунок из J. Polym. Sci., Part A: Polym. Chem. 2007, 45, 4545
Соединение 2 может вступить в реакцию сополимеризации в условиях радикального инициирования, образуя полимер, содержащий в боковых звеньях малеимидные фрагменты. Нагревание полимера до 125˚C способствует реакции элиминирования фурана, после чего полученный сополимер может быть функционализирован за счет реакций присоединения к двойной связи малеинимидного фрагмента.
Агрегация люминесцирующих молекул обычно приводи к гашению их излучения. Тем не менее, за последние годы исследователи обнаружили несколько красителей, проявляющих обратный эффект – агрегационно-инициируемое излучение [aggregation-induced emission (AIE)]. Этот эффект приводит к проявлению люминесценции в результате агрегации люминесцентно инертных молекул. До настоящего времени эффект AIE проявлялся только для органических соединений.
Лю с соавторами из Тайваня и Индии достигли существенного прогресса в изучении эффекта AIE – они наблюдали проявление AIE комплексами переходных металлов [2].
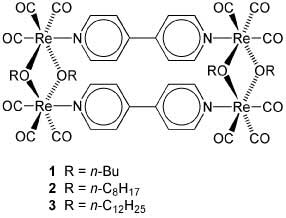
Рисунок из J. Phys. Chem. A 2007, 111, 10953
Изученные комплексы представляют собой кремнийорганические красители, обладающие прямоугольной структурой. (1–3). При полном растворении этих соединений растворы не излучают, однако, будучи растворенными в умеренно растворяющих растворителях, они образуют люминесцентные супрамолекулярные агрегаты. Например, квантовый выход фотолюминесценции комплекса 3 в MeCN низок, при переносе в смесь 9:1 H2O–MeCN квантовый выход увеличивается в 20 раз.
Сандра Ли (Sandra Lee) и Дэвид МакМиллан (W. C. MacMillan) из Принстоновского Университета впервые приводят пример использования солей винильных и гетероарильных производных трифторборной кислоты в качестве субстратов для реакций присоединения. [3].
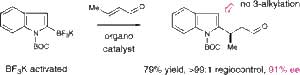
Рисунок из J. Am. Chem. Soc., 129 (50), 15438
Использование иминиевого катализатора, понижающего уровень НСМО позволило осуществить регио- и энантиоселективное 1,4-присоединение солей трифторборной кислоты к альфа,бета-ненасыщенным альдегидам. Солянокислый имидазолидинон катализирует присоединение различных производных BF3, содержащих винильные и арильные фрагменты к широкому кругу еналей.
Нобумаса Камигата (Nobumasa Kamigata) с соавторами из Университета Токио описывает химические превращения ненасыщенных серосодержащх краун-эфиров [4].
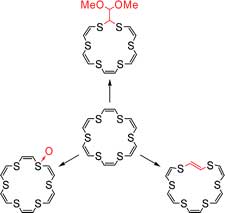
Рисунок из J. Org. Chem., ASAP Article 10.1021/jo701757s
Ненасыщенные 15-, 18- и 21-членные тиокраунэфиры в реакции с м-хлорбензойной кислотой (m-CPBA) окисляются до сульфоксидов. Реакция с t-BuOCl при –20 градусах Цельсия также приводит к образованию сульфокксидов, при комнатной температуре ее продуктами являются продукты цис-транс изомеризации исходных соединений.
Продукты цис-транс изомеризации тиакраунов могут также быть получены в результате фотохимической реакции или в результате взаимодействия с N-хлорсукцинимидом (NCS) и N-хлорфталимидом (NCP). Кроме продукта изомеризации NBS и NBP позволяют получить ацеталь.
Хосе Педро (José R. Pedro) с соавторами из Университета Валенсии описывают реакцию присоединения нитрометана к альфа-кетоэфирам [5].
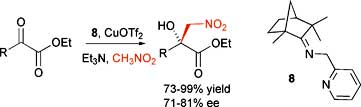
Рисунок из Org. Biomol. Chem., 2008, DOI: 10.1039/b716446g
Комплекс меди и хирального иминопиридина, получаемого в результате простой реакции (R)-(–)-фенхона [(R)-(–)-fenchone] и пиколинамина катализирует энантиоселективную реакцию Генри (нитроальдольная конденсация) нитрометана с альфа-кетоэфирами.
Для представительного ряда альфа-кетоэфиров, имеющих в своей структуре ароматические, алкильные или алкенильные группы, наблюдаются хорошие выходы и хорошая энантиоселективность.
Источники: [1] Polym. Sci., Part A: Polym. Chem. 2007, 45, 4545; [2] J. Phys. Chem. A 2007, 111, 10953; [3] J. Am. Chem. Soc., 129 (50), 15438; [4] J. Org. Chem., ASAP Article 10.1021/jo701757s; [5] Org. Biomol. Chem., 2008, DOI: 10.1039/b716446g
Опубликовано на www.chemport.ru, декабрь